Синдром дефицита внимания с гиперактивностью (СДВГ) характеризуется гиперактивностью и импульсивностью, невниманием или сочетанием гиперактивности, импульсивности и невнимательности, что нарушает развитие и повседневное функционирование. Расстройство обычно диагностируется у детей и до 70% симптомов детских случаев, приводящие к нарушению функционирования, сохраняются и во взрослой жизни.
Лечение людей с СДВГ может быть как фармакологическим, так и нефармакологическим или и тем, и другим.
Лекарства, одобренные Управлением по контролю за продуктами и лекарствами (FDA), включают стимуляторы (амфетамины и метилфенидат) и нестимуляторы (атомоксетин, клонидин с пролонгированным высвобождением и гуанфацин).
Стимуляторы обычно рекомендуются в качестве фармакологического лечения первой линии.
После отчета в 1937 году о положительном влиянии соединения амфетамина на симптомы СДВГ и одобрения метилфенидата FDA в 1955 году было опубликовано много исследований фармакотерапии СДВГ. В этом обзоре обобщены последние данные о лекарствах от СДВГ, которые были одобрены регулирующими органами, но не рассматриваются целесообразность или нецелесообразность использования этих лекарств.
Распространенность употребления лекарств увеличилась с 2001 по 2015 год, при этом среднегодовое относительное увеличение в процентном отношении составляет от 2,83% в Соединенных Штатах до 45,11% в Канаде среди детей и подростков и с 7,94% на Тайване до 75,88% в Японии среди взрослых. Согласно базам данных, из которых получены эти цифры, распространенность использования лекарств от СДВГ была существенно ниже, чем предполагаемая распространенность СДВГ в те же периоды, за исключением США и Исландии ( рис 1.)
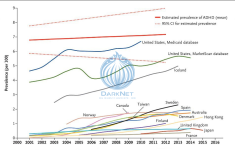
Рисунок 1. Ежегодная распространенность использования лекарств от синдрома дефицита внимания и гиперактивности (СДВГ) среди лиц в возрасте от 3 до 18 лет, по данным каждой страны.Данные о распространенности использования лекарств основаны на ретроспективном наблюдательном исследовании Raman et al. Жирная красная линия показывает предполагаемую среднюю распространенность СДВГ, пунктирные красные линии указывают 95% доверительный интервал на основе модели мета-регрессии со смешанными эффектами от Polanczyk et al. Модель показала, что после корректировки методов исследования оценки распространенности СДВГ существенно не менялись в зависимости от года или географического положения.
В течение 12-месячных периодов наблюдения в различных исследованиях, включенных в систематический обзор, средняя продолжительность лечения стимуляторами составляла 136 дней для детей и 230 дней для взрослых.
Самые высокие показатели прекращения приема лекарств были зарегистрированы у пациентов в возрасте от 15 до 21 года, и причины прекращения включали побочные эффекты, предполагаемую неэффективность, неприязнь к приему лекарств, решение о том, что лечение не требуется, стигма и проблемы с переходом с детских на взрослые услуги.
Для справки: величина эффекта стимуляторов у детей и подростков с СДВГ была больше, чем сообщалось в краткосрочных РКИ психиатрических препаратов при различных других расстройствах.
В некоторых фармакоэпидемиологических исследованиях использовался индивидуальный план, сравнивающий результаты во время периодов приема и прекращения приема лекарств у одного и того же человека, чтобы учесть искажение назначения лекарств по показаниям. В периоды, когда пациенты принимали лекарства, эти исследования показали значительное снижение негативных результатов, таких как непреднамеренные физические травмы, дорожно-транспортные происшествия (среди пациентов мужского пола), расстройство, связанное с употреблением психоактивных веществ, преступные действия, а также улучшение успеваемости.
Определение долгосрочных эффектов лекарств от СДВГ было сложной задачей из-за трудности преодоления предвзятости и путаницы в исследованиях, сравнивающих леченных и нелеченных пациентов. В двойном слепом РКИ по прекращению приема лекарств, в котором участникам, которые лечились метилфенидатом в среднем 4,5 года, случайным образом распределили для продолжения или прекращения приема, продолжение было связано с сохраняющимся преимуществом в отношении симптомов СДВГ по сравнению с прекращением лечения и переходом на плацебо.
Но величина эффекта для получения преимущества была меньше, чем сообщалось в краткосрочных РКИ лечения метилфенидатом. Это могло быть связано со снижением эффективности лекарства с течением времени, неадекватной корректировкой дозы. Влияние лекарств от СДВГ на показатели качества жизни непоследовательно коррелировало со снижением симптомов СДВГ. По различным параметрам качества жизни, используемым в РКИ (включая рандомизированные испытания, в которых прекращают лечение), эффекты лекарств от СДВГ варьировались от незначительных до значимых.
Метилфенидат у детей и подростков и амфетамины у взрослых были единственными лекарствами, которые снижали процент выбывания по любой причине по сравнению с плацебо.
Краткосрочные испытания показали значительное увеличение частоты сердечных сокращений или артериального давления у лиц с СДВГ, получавших стимуляторы или атомоксетин, по сравнению с плацебо.
В метаанализе РКИ стимуляторов у взрослых среднее увеличение частоты сердечных сокращений составило 5,7 ударов в минуту, а среднее повышение систолического артериального давления – 2,0 мм рт.
В РКИ электрокардиографические изменения, считающиеся аномальными, не наблюдались или наблюдались менее чем у 2% участников , но пациенты с ранее существовавшими сердечно-сосудистыми заболеваниями, вероятно, были исключены из этих испытаний.
Стимулирующее лечение, которое было начато в детстве и продолжалось в течение 10 лет, не увеличивало риск гипертонии в течение 10-летнего периода, но было связано с умеренным увеличением частоты сердечных сокращений на 8-м году жизни. Несмотря на то, что небольшое, но стойкое повышение артериального давления или частоты сердечных сокращений вызывает беспокойство, если оно сохраняется в течение длительного периода, метаанализ не показал значимой связи между фармакологическим лечением СДВГ и внезапной смертью, инсультом, инфарктом миокарда или смертью от любой причины, но доверительные интервалы для объединенных оценок не исключали умеренного увеличения риска.
Использование стимуляторов у детей с СДВГ привело к снижению роста на 1 см в год в течение первых 3 лет лечения.
Объединенные данные исследований с участием детей в возрасте от 6 до 7 лет показали, что после лечения атомоксетином в течение 2 лет рост был примерно на 2,7 см меньше, чем ожидалось в соответствии с исходными показателями роста. В одном исследовании дефицит роста со временем уменьшался.
При 16-летнем наблюдении за пациентами, которые начали лечение стимуляторами в детстве, лица, получавшие лечение не менее 50% дней, были в среднем на 4,1 см ниже, чем те, кто получал лечение менее чем в 50% дней , но нерандомизированный характер этого исследования препятствует однозначной интерпретации результатов. Другие исследования показали, что через несколько месяцев после прекращения лечения, рост взрослого человека не изменился.
Ограниченное количество исследований с участием людей показало, что, пока пациенты лечились препаратами от СДВГ, снижались риски судорог, депрессии, мании (при одновременном лечении метилфенидатом и стабилизаторами настроения) и – у лиц, получавших стимуляторы, – суицидальности. Также не увеличивался риск суицидальности (при приеме не стимулирующих средств) или психоза (при приеме метилфенидата).
В обзоре наблюдательных исследований с дизайном, направленным на уменьшение искажения, различия в риске исходов, связанных с беременностью и потомством, между женщинами, принимавшими лекарства от СДВГ во время беременности, и контрольными группами варьировались от 0,01% для основных пороков развития до 3,90% для кесарева сечения. Повышенный риск среди женщин, получающих лекарства от СДВГ, мог быть связан с лекарствами или с остаточным вмешательством.
В ходе рандомизированных исследований наиболее устойчивым эффектом однократной дозы стимуляторов является усиление во время нейропсихологических задач активности правой нижней лобной коры и островка, которые вместе участвуют в контроле и торможении внимания.
Метилфенидат также временно нормализует паттерн активации других сетей мозга, таких как сеть пассивного режима работы мозга, которая обычно отключается у всех во время задач, требующих внимания, но в меньшей степени деактивируется у людей с СДВГ, которые не получают лечения.
Что касается долгосрочных нейробиологических эффектов, у пациентов с СДВГ, которые получали стимуляторы более 6 месяцев, активация в головке хвостатого ядра может быть близка к нормальному уровню во время задач, требующих внимания, тогда как активация в этой области обычно снижена у лиц с СДВГ, не получающих лечения.
На групповом уровне у детей с СДВГ были обнаружены меньшие средние размеры коры в нескольких областях мозга по сравнению с контрольной группой, но лечение стимуляторами не учитывало разницу.
В том же обзоре до 58,7% студентов колледжей в Соединенных Штатах сообщили о немедицинском использовании стимуляторов по крайней мере в одном случае, а 2,1% взрослых в Соединенных Штатах признали хотя бы один эпизод немедицинского употребления стимуляторов в предыдущем году.
Наиболее частой мотивацией для немедицинского использования стимуляторов было повышение успеваемости или производительности труда, за которым следовало использование в рекреационных целях («кайф»).
Самолечение недиагностированного СДВГ может быть другим объяснением, поскольку люди, которые использовали стимуляторы в немедицинских целях, сообщали о большем количестве симптомов СДВГ, чем те, кто не принимал немедицинские стимуляторы. Поэтому возможно завышение сведений о симптомах СДВГ в исследованиях, включенных в обзор.
В крупных исследованиях (> 10 000 участников) в обзоре немедицинское употребление стимуляторов было связано с симптомами, которые были опасными для жизни или вызывали клинически значимую инвалидность у 0,4% пользователей. Данные токсикологических центров показали повышенный риск смерти при назальном или внутривенном введении стимуляторов.
Некоторые негативные последствия СДВГ, такие как несчастные случаи и употребление запрещенных наркотиков, также могут быть снижены.
Побочные эффекты во время лечения обычно поддаются коррекции, но безопасность вызывает беспокойство у некоторых пациентов, особенно у пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями. Причины прекращения приема лекарств пациентами включают побочные эффекты, предполагаемую недостаточную эффективность, неприязнь к приему лекарств и стигматизацию.
Выбор наиболее подходящего лекарства для каждого пациента в настоящее время осуществляется методом проб и ошибок, и нашего понимания нейробиологии СДВГ еще недостаточно для обоснования выбора лекарства. В будущем включение биомаркеров и клинических предикторов ответа и побочных эффектов может позволить клиницистам адаптировать лечение к потребностям отдельных пациентов.
Продвинутые фармакоэпидемиологические подходы могут дать более точную оценку долгосрочных эффектов лекарств от СДВГ. Достижения в области генетики, сфокусированные на генах, которые кодируют или являются мишенью лекарств, могут привести к разработке соединений с новыми механизмами действия.
Источники для пытливых
1.Feldman HM, Reiff MI. Attention deficit–hyperactivity disorder in children and adolescents. N Engl J Med 2014;370:838-846.
2.Faraone SV, Asherson P, Banaschewski T, et al. Attention-deficit/hyperactivity disorder. Nat Rev Dis Primers 2015;1:15020-15020.
3.Wolraich ML, Hagan JF Jr, Allan C, et al. Clinical practice guideline for the diagnosis, evaluation, and treatment of attention-deficit/hyperactivity disorder in children and adolescents. Pediatrics 2019;144(4):e20192528-e20192528.
4.National Institute for Health and Care Excellence (NICE). Attention deficit hyperactivity disorder: diagnosis and management. NICE guideline NG87. March 14, 2018
5.Association of the Scientific Medical Societies in Germany (AWMF). Interdisciplinary evidence- and consensus-based (S3) guideline “Attention deficit/hyperactivity disorder in children, young people and adults.” 2018. (In German) (https://www.awmf.org/uploads/tx_szleitlinien/028-045l_S3_ADHS_2018-06.pdf ).
6.Raman SR, Man KKC, Bahmanyar S, et al. Trends in attention-deficit hyperactivity disorder medication use: a retrospective observational study using population-based databases. Lancet Psychiatry 2018;5:824-835.
7.Polanczyk GV, Willcutt EG, Salum GA, Kieling C, Rohde LA. ADHD prevalence estimates across three decades: an updated systematic review and meta-regression analysis. Int J Epidemiol 2014;43:434-442.
8.Gajria K, Lu M, Sikirica V, et al. Adherence, persistence, and medication discontinuation in patients with attention-deficit/hyperactivity disorder — a systematic literature review. Neuropsychiatr Dis Treat 2014;10:1543-1569.
9.Zetterqvist J, Asherson P, Halldner L, Långström N, Larsson H. Stimulant and non-stimulant attention deficit/hyperactivity disorder drug use: total population study of trends and discontinuation patterns 2006-2009. Acta Psychiatr Scand 2013;128:70-77.
10.Cortese S, Adamo N, Del Giovane C, et al. Comparative efficacy and tolerability of medications for attention-deficit hyperactivity disorder in children, adolescents, and adults: a systematic review and network meta-analysis. Lancet Psychiatry 2018;5:727-738.
11.Leucht S, Hierl S, Kissling W, Dold M, Davis JM. Putting the efficacy of psychiatric and general medicine medication into perspective: review of meta-analyses. Br J Psychiatry 2012;200:97-106.
12.Arnold LE. Methylphenidate vs. amphetamine: comparative review. J Atten Disord 2000;3:200-211.
13.Chang Z, Ghirardi L, Quinn PD, Asherson P, D’Onofrio BM, Larsson H. Risks and benefits of attention-deficit/hyperactivity disorder medication on behavioral and neuropsychiatric outcomes: a qualitative review of pharmacoepidemiology studies using linked prescription databases. Biol Psychiatry 2019;86:335-343.
14.Matthijssen A-FM, Dietrich A, Bierens M, et al. Continued benefits of methylphenidate in ADHD after 2 years in clinical practice: a randomized placebo-controlled discontinuation study. Am J Psychiatry 2019;176:754-762.
15.Coghill DR, Banaschewski T, Soutullo C, Cottingham MG, Zuddas A. Systematic review of quality of life and functional outcomes in randomized placebo-controlled studies of medications for attention-deficit/hyperactivity disorder. Eur Child Adolesc Psychiatry 2017;26:1283-1307.
16.Tsujii N, Okada T, Usami M, et al. Effect of continuing and discontinuing medications on quality of life after symptomatic remission in attention-deficit/hyperactivity disorder: a systematic review and meta-analysis. J Clin Psychiatry 2020;81:19r13015-19r13015.
17.Cortese S, Holtmann M, Banaschewski T, et al. Practitioner review: current best practice in the management of adverse events during treatment with ADHD medications in children and adolescents. J Child Psychol Psychiatry 2013;54:227-246.
18.Mick E, McManus DD, Goldberg RJ. Meta-analysis of increased heart rate and blood pressure associated with CNS stimulant treatment of ADHD in adults. Eur Neuropsychopharmacol 2013;23:534-541.
19.Vitiello B, Elliott GR, Swanson JM, et al. Blood pressure and heart rate over 10 years in the multimodal treatment study of children with ADHD. Am J Psychiatry 2012;169:167-177.
20.Liu H, Feng W, Zhang D. Association of ADHD medications with the risk of cardiovascular diseases: a meta-analysis. Eur Child Adolesc Psychiatry 2019;28:1283-1293.
21.Poulton A. Growth on stimulant medication: clarifying the confusion: a review. Arch Dis Child 2005;90:801-806.
22.Kratochvil CJ, Wilens TE, Greenhill LL, et al. Effects of long-term atomoxetine treatment for young children with attention-deficit/hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 2006;45:919-927.
23.Greenhill LL, Swanson JM, Hechtman L, et al. Trajectories of growth associated with long-term stimulant medication in the Multimodal Treatment Study of Attention-Deficit/Hyperactivity Disorder. J Am Acad Child Adolesc Psychiatry 2020;59:978-989.
24.Faraone SV, Biederman J, Morley CP, Spencer TJ. Effect of stimulants on height and weight: a review of the literature. J Am Acad Child Adolesc Psychiatry 2008;47:994-1009.
25.Li L, Sujan AC, Butwicka A, et al. Associations of prescribed ADHD medication in pregnancy with pregnancy-related and offspring outcomes: a systematic review. CNS Drugs 2020;34:731-747.
26.Rubia K, Alegria AA, Cubillo AI, Smith AB, Brammer MJ, Radua J. Effects of stimulants on brain function in attention-deficit/hyperactivity disorder: a systematic review and meta-analysis. Biol Psychiatry 2014;76:616-628.
27.Liddle EB, Hollis C, Batty MJ, et al. Task-related default mode network modulation and inhibitory control in ADHD: effects of motivation and methylphenidate. J Child Psychol Psychiatry 2011;52:761-771.
28.Hart H, Radua J, Nakao T, Mataix-Cols D, Rubia K. Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects. JAMA Psychiatry 2013;70:185-198.
29.Hoogman M, Muetzel R, Guimaraes JP, et al. Brain imaging of the cortex in ADHD: a coordinated analysis of large-scale clinical and population-based samples. Am J Psychiatry 2019;176:531-542.
30.Faraone SV, Rostain AL, Montano CB, Mason O, Antshel KM, Newcorn JH. Systematic review: nonmedical use of prescription stimulants: risk factors, outcomes, and risk reduction strategies. J Am Acad Child Adolesc Psychiatry 2020;59:100-112.
Источник: N Engl J Med 2020; 383:1050-1056
DOI: 10.1056/NEJMra1917069
Лечение людей с СДВГ может быть как фармакологическим, так и нефармакологическим или и тем, и другим.
Лекарства, одобренные Управлением по контролю за продуктами и лекарствами (FDA), включают стимуляторы (амфетамины и метилфенидат) и нестимуляторы (атомоксетин, клонидин с пролонгированным высвобождением и гуанфацин).
Стимуляторы обычно рекомендуются в качестве фармакологического лечения первой линии.
После отчета в 1937 году о положительном влиянии соединения амфетамина на симптомы СДВГ и одобрения метилфенидата FDA в 1955 году было опубликовано много исследований фармакотерапии СДВГ. В этом обзоре обобщены последние данные о лекарствах от СДВГ, которые были одобрены регулирующими органами, но не рассматриваются целесообразность или нецелесообразность использования этих лекарств.
Использование лекарств при СДВГ
Исследование с использованием базы данных рецептов показало географические различия в распространенности использования лекарств от СДВГ: в 2014 году от 0,39% во Франции до 5,56% в США среди детей и подростков и от 0,01% в Гонконге до 2,11% в США среди взрослых.Распространенность употребления лекарств увеличилась с 2001 по 2015 год, при этом среднегодовое относительное увеличение в процентном отношении составляет от 2,83% в Соединенных Штатах до 45,11% в Канаде среди детей и подростков и с 7,94% на Тайване до 75,88% в Японии среди взрослых. Согласно базам данных, из которых получены эти цифры, распространенность использования лекарств от СДВГ была существенно ниже, чем предполагаемая распространенность СДВГ в те же периоды, за исключением США и Исландии ( рис 1.)

Рисунок 1. Ежегодная распространенность использования лекарств от синдрома дефицита внимания и гиперактивности (СДВГ) среди лиц в возрасте от 3 до 18 лет, по данным каждой страны.Данные о распространенности использования лекарств основаны на ретроспективном наблюдательном исследовании Raman et al. Жирная красная линия показывает предполагаемую среднюю распространенность СДВГ, пунктирные красные линии указывают 95% доверительный интервал на основе модели мета-регрессии со смешанными эффектами от Polanczyk et al. Модель показала, что после корректировки методов исследования оценки распространенности СДВГ существенно не менялись в зависимости от года или географического положения.
В течение 12-месячных периодов наблюдения в различных исследованиях, включенных в систематический обзор, средняя продолжительность лечения стимуляторами составляла 136 дней для детей и 230 дней для взрослых.
Самые высокие показатели прекращения приема лекарств были зарегистрированы у пациентов в возрасте от 15 до 21 года, и причины прекращения включали побочные эффекты, предполагаемую неэффективность, неприязнь к приему лекарств, решение о том, что лечение не требуется, стигма и проблемы с переходом с детских на взрослые услуги.
Эффективность и действенность
Мета-анализ двойных слепых рандомизированных контролируемых исследований (РКИ) со средней продолжительностью 7 недель показал, что лекарства, одобренные для лечения СДВГ, превосходили плацебо в снижении степени невнимательности, гиперактивности и импульсивности по оценке клиницистов с наибольшей величиной эффекта, обнаруженной для амфетаминов, за которыми следует метилфенидат.Для справки: величина эффекта стимуляторов у детей и подростков с СДВГ была больше, чем сообщалось в краткосрочных РКИ психиатрических препаратов при различных других расстройствах.
Однако на уровне пациентов в перекрестных РКИ примерно 41% участников имели одинаково хорошие ответы как на амфетамины, так и на метилфенидат, 28% имели лучший ответ на амфетамины, 16% имели лучший ответ на метилфенидат, а у остальных не было реакции ни на одно из лекарств.Амфетамины были значительно более эффективными, чем метилфенидат, атомоксетин и гуанфацин на групповом уровне.
В некоторых фармакоэпидемиологических исследованиях использовался индивидуальный план, сравнивающий результаты во время периодов приема и прекращения приема лекарств у одного и того же человека, чтобы учесть искажение назначения лекарств по показаниям. В периоды, когда пациенты принимали лекарства, эти исследования показали значительное снижение негативных результатов, таких как непреднамеренные физические травмы, дорожно-транспортные происшествия (среди пациентов мужского пола), расстройство, связанное с употреблением психоактивных веществ, преступные действия, а также улучшение успеваемости.
Определение долгосрочных эффектов лекарств от СДВГ было сложной задачей из-за трудности преодоления предвзятости и путаницы в исследованиях, сравнивающих леченных и нелеченных пациентов. В двойном слепом РКИ по прекращению приема лекарств, в котором участникам, которые лечились метилфенидатом в среднем 4,5 года, случайным образом распределили для продолжения или прекращения приема, продолжение было связано с сохраняющимся преимуществом в отношении симптомов СДВГ по сравнению с прекращением лечения и переходом на плацебо.
Но величина эффекта для получения преимущества была меньше, чем сообщалось в краткосрочных РКИ лечения метилфенидатом. Это могло быть связано со снижением эффективности лекарства с течением времени, неадекватной корректировкой дозы. Влияние лекарств от СДВГ на показатели качества жизни непоследовательно коррелировало со снижением симптомов СДВГ. По различным параметрам качества жизни, используемым в РКИ (включая рандомизированные испытания, в которых прекращают лечение), эффекты лекарств от СДВГ варьировались от незначительных до значимых.
Побочные эффекты и безопасность
В метаанализе РКИ препараты, одобренные для лечения СДВГ, за исключением метилфенидата и атомоксетина у детей и подростков, были связаны с более высокими показателями выбывания из-за побочных эффектов по сравнению с плацебо.Метилфенидат у детей и подростков и амфетамины у взрослых были единственными лекарствами, которые снижали процент выбывания по любой причине по сравнению с плацебо.
Краткосрочные испытания показали значительное увеличение частоты сердечных сокращений или артериального давления у лиц с СДВГ, получавших стимуляторы или атомоксетин, по сравнению с плацебо.
В метаанализе РКИ стимуляторов у взрослых среднее увеличение частоты сердечных сокращений составило 5,7 ударов в минуту, а среднее повышение систолического артериального давления – 2,0 мм рт.
В РКИ электрокардиографические изменения, считающиеся аномальными, не наблюдались или наблюдались менее чем у 2% участников , но пациенты с ранее существовавшими сердечно-сосудистыми заболеваниями, вероятно, были исключены из этих испытаний.
Стимулирующее лечение, которое было начато в детстве и продолжалось в течение 10 лет, не увеличивало риск гипертонии в течение 10-летнего периода, но было связано с умеренным увеличением частоты сердечных сокращений на 8-м году жизни. Несмотря на то, что небольшое, но стойкое повышение артериального давления или частоты сердечных сокращений вызывает беспокойство, если оно сохраняется в течение длительного периода, метаанализ не показал значимой связи между фармакологическим лечением СДВГ и внезапной смертью, инсультом, инфарктом миокарда или смертью от любой причины, но доверительные интервалы для объединенных оценок не исключали умеренного увеличения риска.
Использование стимуляторов у детей с СДВГ привело к снижению роста на 1 см в год в течение первых 3 лет лечения.
Объединенные данные исследований с участием детей в возрасте от 6 до 7 лет показали, что после лечения атомоксетином в течение 2 лет рост был примерно на 2,7 см меньше, чем ожидалось в соответствии с исходными показателями роста. В одном исследовании дефицит роста со временем уменьшался.
При 16-летнем наблюдении за пациентами, которые начали лечение стимуляторами в детстве, лица, получавшие лечение не менее 50% дней, были в среднем на 4,1 см ниже, чем те, кто получал лечение менее чем в 50% дней , но нерандомизированный характер этого исследования препятствует однозначной интерпретации результатов. Другие исследования показали, что через несколько месяцев после прекращения лечения, рост взрослого человека не изменился.
Ограниченное количество исследований с участием людей показало, что, пока пациенты лечились препаратами от СДВГ, снижались риски судорог, депрессии, мании (при одновременном лечении метилфенидатом и стабилизаторами настроения) и – у лиц, получавших стимуляторы, – суицидальности. Также не увеличивался риск суицидальности (при приеме не стимулирующих средств) или психоза (при приеме метилфенидата).
В обзоре наблюдательных исследований с дизайном, направленным на уменьшение искажения, различия в риске исходов, связанных с беременностью и потомством, между женщинами, принимавшими лекарства от СДВГ во время беременности, и контрольными группами варьировались от 0,01% для основных пороков развития до 3,90% для кесарева сечения. Повышенный риск среди женщин, получающих лекарства от СДВГ, мог быть связан с лекарствами или с остаточным вмешательством.
Нейробиологические эффекты лекарств от СДВГ
Наши текущие знания о молекулярных мишенях лекарств от СДВГ в головном мозге не влияют напрямую на выбор лекарств в клинической практике, но эти механизмы полезны для понимания эффектов лекарств.В ходе рандомизированных исследований наиболее устойчивым эффектом однократной дозы стимуляторов является усиление во время нейропсихологических задач активности правой нижней лобной коры и островка, которые вместе участвуют в контроле и торможении внимания.
Метилфенидат также временно нормализует паттерн активации других сетей мозга, таких как сеть пассивного режима работы мозга, которая обычно отключается у всех во время задач, требующих внимания, но в меньшей степени деактивируется у людей с СДВГ, которые не получают лечения.
Что касается долгосрочных нейробиологических эффектов, у пациентов с СДВГ, которые получали стимуляторы более 6 месяцев, активация в головке хвостатого ядра может быть близка к нормальному уровню во время задач, требующих внимания, тогда как активация в этой области обычно снижена у лиц с СДВГ, не получающих лечения.
На групповом уровне у детей с СДВГ были обнаружены меньшие средние размеры коры в нескольких областях мозга по сравнению с контрольной группой, но лечение стимуляторами не учитывало разницу.
Немедицинское использование лекарств от СДВГ
Обзор литературы дал мало доказательств того, что самостоятельное использование лекарств от СДВГ улучшает академическую или рабочую успеваемость у людей без СДВГ.В том же обзоре до 58,7% студентов колледжей в Соединенных Штатах сообщили о немедицинском использовании стимуляторов по крайней мере в одном случае, а 2,1% взрослых в Соединенных Штатах признали хотя бы один эпизод немедицинского употребления стимуляторов в предыдущем году.
Наиболее частой мотивацией для немедицинского использования стимуляторов было повышение успеваемости или производительности труда, за которым следовало использование в рекреационных целях («кайф»).
Самолечение недиагностированного СДВГ может быть другим объяснением, поскольку люди, которые использовали стимуляторы в немедицинских целях, сообщали о большем количестве симптомов СДВГ, чем те, кто не принимал немедицинские стимуляторы. Поэтому возможно завышение сведений о симптомах СДВГ в исследованиях, включенных в обзор.
В крупных исследованиях (> 10 000 участников) в обзоре немедицинское употребление стимуляторов было связано с симптомами, которые были опасными для жизни или вызывали клинически значимую инвалидность у 0,4% пользователей. Данные токсикологических центров показали повышенный риск смерти при назальном или внутривенном введении стимуляторов.
Выводы и дальнейшие направления
Лекарства, используемые для лечения СДВГ, эффективны для снижения невнимательности, гиперактивности и импульсивности в краткосрочной перспективе и могут быть эффективны в течение более длительных периодов.Некоторые негативные последствия СДВГ, такие как несчастные случаи и употребление запрещенных наркотиков, также могут быть снижены.
Побочные эффекты во время лечения обычно поддаются коррекции, но безопасность вызывает беспокойство у некоторых пациентов, особенно у пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями. Причины прекращения приема лекарств пациентами включают побочные эффекты, предполагаемую недостаточную эффективность, неприязнь к приему лекарств и стигматизацию.
Выбор наиболее подходящего лекарства для каждого пациента в настоящее время осуществляется методом проб и ошибок, и нашего понимания нейробиологии СДВГ еще недостаточно для обоснования выбора лекарства. В будущем включение биомаркеров и клинических предикторов ответа и побочных эффектов может позволить клиницистам адаптировать лечение к потребностям отдельных пациентов.
Продвинутые фармакоэпидемиологические подходы могут дать более точную оценку долгосрочных эффектов лекарств от СДВГ. Достижения в области генетики, сфокусированные на генах, которые кодируют или являются мишенью лекарств, могут привести к разработке соединений с новыми механизмами действия.
Источники для пытливых
1.Feldman HM, Reiff MI. Attention deficit–hyperactivity disorder in children and adolescents. N Engl J Med 2014;370:838-846.
2.Faraone SV, Asherson P, Banaschewski T, et al. Attention-deficit/hyperactivity disorder. Nat Rev Dis Primers 2015;1:15020-15020.
3.Wolraich ML, Hagan JF Jr, Allan C, et al. Clinical practice guideline for the diagnosis, evaluation, and treatment of attention-deficit/hyperactivity disorder in children and adolescents. Pediatrics 2019;144(4):e20192528-e20192528.
4.National Institute for Health and Care Excellence (NICE). Attention deficit hyperactivity disorder: diagnosis and management. NICE guideline NG87. March 14, 2018
5.Association of the Scientific Medical Societies in Germany (AWMF). Interdisciplinary evidence- and consensus-based (S3) guideline “Attention deficit/hyperactivity disorder in children, young people and adults.” 2018. (In German) (https://www.awmf.org/uploads/tx_szleitlinien/028-045l_S3_ADHS_2018-06.pdf ).
6.Raman SR, Man KKC, Bahmanyar S, et al. Trends in attention-deficit hyperactivity disorder medication use: a retrospective observational study using population-based databases. Lancet Psychiatry 2018;5:824-835.
7.Polanczyk GV, Willcutt EG, Salum GA, Kieling C, Rohde LA. ADHD prevalence estimates across three decades: an updated systematic review and meta-regression analysis. Int J Epidemiol 2014;43:434-442.
8.Gajria K, Lu M, Sikirica V, et al. Adherence, persistence, and medication discontinuation in patients with attention-deficit/hyperactivity disorder — a systematic literature review. Neuropsychiatr Dis Treat 2014;10:1543-1569.
9.Zetterqvist J, Asherson P, Halldner L, Långström N, Larsson H. Stimulant and non-stimulant attention deficit/hyperactivity disorder drug use: total population study of trends and discontinuation patterns 2006-2009. Acta Psychiatr Scand 2013;128:70-77.
10.Cortese S, Adamo N, Del Giovane C, et al. Comparative efficacy and tolerability of medications for attention-deficit hyperactivity disorder in children, adolescents, and adults: a systematic review and network meta-analysis. Lancet Psychiatry 2018;5:727-738.
11.Leucht S, Hierl S, Kissling W, Dold M, Davis JM. Putting the efficacy of psychiatric and general medicine medication into perspective: review of meta-analyses. Br J Psychiatry 2012;200:97-106.
12.Arnold LE. Methylphenidate vs. amphetamine: comparative review. J Atten Disord 2000;3:200-211.
13.Chang Z, Ghirardi L, Quinn PD, Asherson P, D’Onofrio BM, Larsson H. Risks and benefits of attention-deficit/hyperactivity disorder medication on behavioral and neuropsychiatric outcomes: a qualitative review of pharmacoepidemiology studies using linked prescription databases. Biol Psychiatry 2019;86:335-343.
14.Matthijssen A-FM, Dietrich A, Bierens M, et al. Continued benefits of methylphenidate in ADHD after 2 years in clinical practice: a randomized placebo-controlled discontinuation study. Am J Psychiatry 2019;176:754-762.
15.Coghill DR, Banaschewski T, Soutullo C, Cottingham MG, Zuddas A. Systematic review of quality of life and functional outcomes in randomized placebo-controlled studies of medications for attention-deficit/hyperactivity disorder. Eur Child Adolesc Psychiatry 2017;26:1283-1307.
16.Tsujii N, Okada T, Usami M, et al. Effect of continuing and discontinuing medications on quality of life after symptomatic remission in attention-deficit/hyperactivity disorder: a systematic review and meta-analysis. J Clin Psychiatry 2020;81:19r13015-19r13015.
17.Cortese S, Holtmann M, Banaschewski T, et al. Practitioner review: current best practice in the management of adverse events during treatment with ADHD medications in children and adolescents. J Child Psychol Psychiatry 2013;54:227-246.
18.Mick E, McManus DD, Goldberg RJ. Meta-analysis of increased heart rate and blood pressure associated with CNS stimulant treatment of ADHD in adults. Eur Neuropsychopharmacol 2013;23:534-541.
19.Vitiello B, Elliott GR, Swanson JM, et al. Blood pressure and heart rate over 10 years in the multimodal treatment study of children with ADHD. Am J Psychiatry 2012;169:167-177.
20.Liu H, Feng W, Zhang D. Association of ADHD medications with the risk of cardiovascular diseases: a meta-analysis. Eur Child Adolesc Psychiatry 2019;28:1283-1293.
21.Poulton A. Growth on stimulant medication: clarifying the confusion: a review. Arch Dis Child 2005;90:801-806.
22.Kratochvil CJ, Wilens TE, Greenhill LL, et al. Effects of long-term atomoxetine treatment for young children with attention-deficit/hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 2006;45:919-927.
23.Greenhill LL, Swanson JM, Hechtman L, et al. Trajectories of growth associated with long-term stimulant medication in the Multimodal Treatment Study of Attention-Deficit/Hyperactivity Disorder. J Am Acad Child Adolesc Psychiatry 2020;59:978-989.
24.Faraone SV, Biederman J, Morley CP, Spencer TJ. Effect of stimulants on height and weight: a review of the literature. J Am Acad Child Adolesc Psychiatry 2008;47:994-1009.
25.Li L, Sujan AC, Butwicka A, et al. Associations of prescribed ADHD medication in pregnancy with pregnancy-related and offspring outcomes: a systematic review. CNS Drugs 2020;34:731-747.
26.Rubia K, Alegria AA, Cubillo AI, Smith AB, Brammer MJ, Radua J. Effects of stimulants on brain function in attention-deficit/hyperactivity disorder: a systematic review and meta-analysis. Biol Psychiatry 2014;76:616-628.
27.Liddle EB, Hollis C, Batty MJ, et al. Task-related default mode network modulation and inhibitory control in ADHD: effects of motivation and methylphenidate. J Child Psychol Psychiatry 2011;52:761-771.
28.Hart H, Radua J, Nakao T, Mataix-Cols D, Rubia K. Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects. JAMA Psychiatry 2013;70:185-198.
29.Hoogman M, Muetzel R, Guimaraes JP, et al. Brain imaging of the cortex in ADHD: a coordinated analysis of large-scale clinical and population-based samples. Am J Psychiatry 2019;176:531-542.
30.Faraone SV, Rostain AL, Montano CB, Mason O, Antshel KM, Newcorn JH. Systematic review: nonmedical use of prescription stimulants: risk factors, outcomes, and risk reduction strategies. J Am Acad Child Adolesc Psychiatry 2020;59:100-112.
Источник: N Engl J Med 2020; 383:1050-1056
DOI: 10.1056/NEJMra1917069
