Депрессия – это разрушительное психическое расстройство, поражающее 20% населения во всем мире. Несмотря на доказанную эффективность, антидепрессанты проявляют замедленное начало действия и серьезные побочные эффекты. В 2010 году был описан спадин (PE 12-28) как многообещающий эндогенный пептид с антидепрессивной активностью [1]. Спадин специфически блокирует канал TREK-1. В статье [1] показано in vivo, что активность спадина исчезала через 7 ч после введения. Чтобы улучшить стабильность и биодоступность спадина in vivo, был проведён скрининг аналогов и производных спадина. На основе изучения продуктов распада спадина в крови был разработан пептид из 7 аминокислот, PE 22-28. Исследования In vitro на клетках hTREK-1/HEK с использованием метода patch-clamp показали, что PE 22-28 проявляет лучшую специфичность и сродство к каналу TREK-1 по сравнению со спадином, IC50 0,12 нМ по сравнению с 40-60 нМ для спадина. В тех же условиях мы также отметили, что различные модификации его N-или С-концевых концов поддерживали или отменяли активность TREK-1 канала, не влияя на сродство к PE 22-28. In vivo антидепрессивные свойства PE 22-28 и его производных были продемонстрированы в поведенческих моделях депрессии, таких как тест на принудительное плавание. Мыши, получавшие аналоги спадина, показали значительное сокращение времени неподвижности. Более того, в новом тесте с подавленным питанием после 4-дневного субхронического лечения PE 22-28 значительно сократил время ожидания перед употреблением пищевой гранулы. PE 22-28 и его аналоги смогли индуцировать нейрогенез уже после 4-дневного лечения с заметным эффектом G / A-PE 22-28. На нейронах коры головного мозга мышей PE 22-28 и его производные усиливали синаптогенез, измеряемый по увеличению уровня экспрессии PSD-95. Наконец, продолжительность действия PE 22-28 и его аналогов была значительно улучшена по сравнению со спадином, до 23 ч вместо 7 ч. В рамках этой статьи будут рассмотрены результаты научных работ о том, что PE 22-28 и его производные представляют собой другие перспективные молекулы, которые могут стать альтернативой спадину при лечении депрессии.
Позже было разработано несколько антидепрессантов (AD) с целью восстановления физиологических синаптических уровней трех нейротрансмиттеров [4]. Для лечения депрессии использовались и продолжают использоваться несколько типов препаратов от БА (Болезни Альцгеймера). Первоначально депрессию в основном лечили препаратами семейства трициклических препаратов и в меньшей степени ингибиторами моноаминоксидазы (MAOIs) и ингибиторами обратного захвата серотонина и норэпинефрина (SNRI). Однако эти классы AD проявляют многочисленные и серьезные побочные эффекты.
Чтобы снизить частоту и возникновение этих побочных эффектов, эти препараты были заменены новым поколением ADS, более специфичных и с меньшими побочными эффектами. Сюда входят ингибиторы обратного захвата серотонина (СИОЗС) и ингибиторы обратного захвата норэпинефрина (NSRI), которые широко используются в настоящее время и рекомендуются в качестве лечения депрессии первой линии [2,3]. Считается, что СИОЗС и НПВС повышают синаптическую концентрацию моноаминов за счет ингибирования обратного захвата 5-НТ или NA путем блокирования их специфических переносчиков, SERT и NAT, соответственно [5]. Эти препараты от депрессии лучше переносятся, но их эффективность у пациентов с депрессией на самом деле не улучшилась. С другой стороны, фактические ADS, такие как флуоксетин, эффективны только после 3-4 недель лечения, латентный период, который все еще остается необъяснимым [2,3]. Таким образом, необходимо обнаружить и охарактеризовать новые мишени для новых препаратов от депресии.
Недавно были описаны различные препараты от быстрого развития БА, такие как кетамин, скополамин или GLYX-13 [2,6]. Тем не менее, эти молекулы, особенно кетамин, вызывают ряд побочных эффектов [2]. Мультимодальные препараты, такие как вортиоксетин или вилазодон, представляют собой новый класс ADS, недавно одобренный Управлением по контролю за продуктами питания и лекарствами США для лечения основных депрессивных расстройств [2,7]. Тем не менее, эти препараты не продемонстрировали явного улучшения эффективности антидепрессантов, но вортиоксетин продемонстрировал благоприятное действие при когнитивных нарушениях, связанных с депрессией, тогда как вилазодон, по-видимому, вызывал незначительные сексуальные дисфункции [8].
Несмотря на этот терапевтический арсенал, более 30% пациентов с депрессией никогда не проходят ремиссию даже после нескольких классических методов лечения. Альтернативой медикаментозной терапии у резистентных пациентов является электросудорожная терапия (ЭСТ). ЭСТ эффективна у 50% пациентов, резистентных к фармакотерапии, но ЭСТ также вызывает некоторые побочные эффекты, в основном в когнитивных процессах [2,9]. Таким образом, открытие новых препаратов от депрессии является сложной задачей.
В 2006 году был идентифицирован селективный двухпористый калиевый канал TREK-1 (связанный с TWIK калиевый канал-1) как потенциальная мишень для лечения депрессии [2,10]. Каналы TREK-1 являются повсеместными калиевыми каналами, которые играют ключевую роль в стабилизации мембранного потенциала и, таким образом, предотвращают клеточную возбудимость. Каналы TREK-1 являются очень специфическими K2P каналами, поскольку они вовлечены во многие физиологические и физиопатологические процессы, такие как боль, эпилепсия, инсульт и депрессия [2,10,11]. TREK-1 также стал привлекательной мишенью для исследований сердечно-сосудистой системы, поскольку он играет важную роль в фибрилляции предсердий, легочной артериальной гипертензии и желудочковой аритмии [2].
Что касается депрессии, в статье [10] показано на пяти различных моделях депрессии, что делеция гена kcnk2, который кодирует каналы TREK-1, приводит к устойчивому к депрессии фенотипу, связанному с усиленной серотонинергической нейротрансмиссией и усиленным нейрогенезом в гиппокампе. Эти наблюдения привели ученых к поиску мощных блокаторов TREK-1. Затем они идентифицировали спадин, который происходит из более крупного пептида, называемого пропептидом (PE) [1,2]. PE представляет собой 44 аминокислоты, образующиеся в результате посттрансляционного созревания в аппарате Гольджи сортилина, также известного как рецептор нейротензина-3 [12].
Спадин – это быстродействующий препарат, который не оказывает никаких побочных эффектов на функции, контролируемые каналом TREK-1 [2]. Он способен противодействовать депрессии всего за 4 дня, когда для эффективной классической ADS требуется 3-4 недели [1,2]. Более того, спадин блокирует TREK-1 с более высоким сродством, IC50~ 40-60 нМ по сравнению с IC50~ 6 мкм для наиболее часто используемого флуоксетина СИОЗС [2,13]. Однако у мышей АД-активность спадина, измеряемая методом FST, исчезает через 7 ч после острого внутривенного введения [2]. Чтобы улучшить стабильность спадина in vivo, было решено поискать аналоги или производные спадина. В предыдущих исследованиях были идентифицированы два аналога, аналоги 3 и 8, которые были синтезированы с использованием технологии retro-inverso [2]. Хотя выигрыш в отношении сродства и продолжительности действия составил около 20 единиц, этого недостаточно, чтобы сделать эти аналоги конкурентоспособными в отношении стоимости их синтеза по сравнению со спадином.
Затем было принято решение поискать укороченные аналоги. Сначала ученые изучили, разрушается ли спадин в кровообращении, в свзяи с чем, были идентифицированы два укороченных пептида [2]. Сравнивая их способность ингибировать канал TREK-1, экспрессируемый в клеточной линии hTREK-1 / HEK [13], была идентифицирована самая короткая эффективная последовательность, которая содержала только 7 аминокислот, называемая PE 22-28. Этот пептид использовали в качестве основной последовательности для получения аналогов путем химической модификации его N-или С-концевых окончаний, а также путем замены аминокислот. Как и PE 22-28, некоторые модифицированные пептидные аналоги проявляли лучшую эффективность в блокировании канала TREK-1 и, что более важно, они сохранили свои свойства при лечении депрессии при использовании в момент острой или субхронической формы.
Рис. 1. Профили продуктов распада спадина в сыворотке с помощью ВЭЖХ. (А) Типичный профиль ВЭЖХ, полученный после 30-минутной инкубации спадина с мышиной сывороткой при 37°C. Положение пика спадина указано стрелкой. (B) Кинетика появления пиков 1 (PE 14-28) и 2 (PE 12-27). (C) Последовательности укороченных пептидов и их способность ингибировать активность TREK-1 по сравнению с последовательностями PE и спадина (PE 12-28) [2].
Таблица 1. Аналоги Спадина и их способность ингибировать активность TREK-1 канала и сокращать время неподвижности при FST [2].
Ученые в работе [2] протестировали и другие аналоги, но они не смогли ингибировать ток TREK-1 (таблица 1). Соответствующие кривые зависимости тока от напряжения показаны на дополнительном рисунке 1.
Все проверенные аналоги, способные ингибировать канал TREK-1, также демонстрировали свойства антидепрессантов, измеренные с помощью теста принудительного плавания (FST) (рисунок 3A, таблица 1).
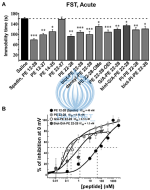
Рис. 3. Кривые FST и “доза-эффект” текущего ингибирования TREK-1 аналогами спадина. (A) Пептиды, способные ингибировать активность TREK-1 канала, были протестированы в FST. Время неподвижности измеряли через 30 мин после внутривенной инъекции и сравнивали со временем неподвижности, полученным у мышей, которым вводили физиологический раствор. Спадин вводили в дозе 100 мкг / кг, а аналоги спадина вводили в дозе 3,2–4,0 мкг / кг. *p < 0,05, **p < 0,01, ***p <0,001. (B) Кривые зависимости дозы от текущего ингибирования TREK-1 при 0 мВ, полученные с аналогами спадина по сравнению со спадином. IC50 составляли 0,1, 0,12, 1,2 и 40,0 нМ для PE 22-28, G/A-PE 22-28, биотинилированного G/A-PE 22-28 и спадина соответственно [2].
Анализ электрофизиологических и поведенческих данных позволил исследователям сосредоточить дальнейшие исследования на PE 22-28, G / A-PE 22-28 и биотинилированном G / A-PE 22-28. Эти три пептида далее называются аналогами спадина (выделены жирным шрифтом в таблице 1). Они обладали общими свойствами по борьбе с депрессией, высоким процентом текущего ингибирования TREK-1 и имели сродство к TREK-1, которое было значительно увеличено по сравнению со спадином (рисунок 3B). Измеренные значения IC 50 составили 40, 0,12, 0,10 и 1,2 нМ для PE 12-28 (Спадин), PE 22-28, G/A-PE 22-28 и биотинилированного G/A-PE 22-28 соответственно.
Рис. 4. Специфичность аналогов спадина. (A–D) PE 22-28 использовали в качестве репрезентативного пептида для тестирования специфичности аналогов спадина по сравнению с другими каналами K2P, TREK-2 (A), TRAAK (B), TRESK (C) и TASK-1 (D). (E-G) Аналоги спадина не влияли на активность канала hERG. Плотности тока в конце импульсов (E), плотности тока в хвостовых токах (F) и типичные следы, полученные при +40 мВ с аналогами спадина (G) [2].
Что еще более важно, аналоги спадина, протестированные в более высоких концентрациях (10 мкм), не изменяли ток IKr, генерируемый каналами hERG (рисунки 4E-G). Ток IKr является наиболее важным реполяризующим током в сердце [2,17]. Дисфункция этих каналов может привести к летальному исходу в результате пуантоза, которые являются одним из наиболее важных побочных эффектов, наблюдаемых при применении препаратов от БА [17].
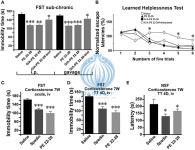
Как и спадин, аналоги спадина были эффективны после субхронического лечения. Независимо от того, вводились ли они внутривенно (3,0 мкг / кг) или через зонд (1 мг / кг) (рисунок 5A), они оставались активными в течение длительного времени. Затем ученые подвергли мышей тесту на выученную беспомощность, валидированному и эффективному тесту для идентификации молекул депрессии. 4-дневное субхроническое лечение аналогами спадина (3,0 мкг / кг, ip) значительно уменьшило латентность выхода (рисунок 5B).
В химически индуцированной модели депрессии с использованием длительного (7 недель) лечения кортикостероном [18] PE 22-28 проявлял те же свойства АД, что и спадин, после острого или субхронического лечения (3,0 мкг/кг) (Рисунки 5C-E). В ФСТ, ЧП 22-28 (3.0 мкг/кг, ИП) был немного более эффективным в уменьшении неподвижности времени (98.1 ± 8.78 ы, н = 10, П < 0.0001), чем спадин (100 мкг/кг; 117.4 ± 6.85 ы, н = 10, П < 0.0001) в этой модели депрессии по сравнению с контролем (164.9 ± 6.03 ы) (рис. 5С). Более того, 4-дневные субхронические введения аналогов спадина были значительно эффективнее в сокращении времени неподвижности (89,60 ± 7,7 с, n = 10, p <0,0001) по сравнению со спадином (107,5 ± 6,5 с, n = 10, p <0,0001) или физиологическим раствором (158,3 ±7,15 с, n = 10; Рисунок 5D). Эти данные подтвердили адгезивное действие аналогов спадина на контрольных мышей с депрессией, индуцированной кортикостероном.
Рис. 5. Поведение аналогов спадина на мышиной модели депрессии. (A) FST, выполненную после субхронического (4 дня) лечения (3,0–4,0 мкг / кг) каждым аналогом спадина или 0,9% физиологическим раствором NaCl. Лечение проводилось либо внутривенной инъекцией (100 мкг / кг), либо через зонд (1,0 мг / кг). (B) Тест на выученную беспомощность проводили с каждым аналогом спадина (3,0–4,0 мкг / кг). 30 исследований были разделены на 6 пулов по пять испытаний. *p < 0,05. (C, D) Модель депрессии, индуцированная кортикостероном. PE 22-28 использовали в качестве репрезентативного пептида для аналогов спадина для сравнения эффектов аналогов спадина с эффектами спадина в этой химически индуцированной модели мыши. FST проводится после острой (через 30 мин после инъекции, (C) или субхронической (4 дня лечения, D) внутривенной инъекции спадина (100 мкг / кг) или PE 22-28 (3,0 мкг / кг). До NSF также применялись субхронические методы лечения, назначаемые в тех же дозах (E). *p < 0,05, **p < 0,01, ***p <0,001 [2].
При NSF 4-дневное субхроническое лечение PE 22-28 (3 мкг/кг) или спадином (100 мкг/кг) значительно уменьшало задержку перед употреблением пищевой таблетки (129,2 ± 15,28 с, n = 10, p < 0,05) и (153,2 ± 5,41 с, n = 10, p < 0,05) в группах спадина и PE 22-28, соответственно по сравнению с контролем (226,1±34,97 с, n = 10) в модели депрессии, индуцированной кортикостероном (рисунок 5E). Тест NSF предсказывает не только депрессию, но и нейрогенез [2,19]. Начуное сообщество предпологает, что аналоги спадина могут усиливать нейрогенез в коре головного мозга и гиппокампе.
Рис. 6. Рисунок 6. Нейрогенез и синаптогенез. (A) Нейрогенез оценивали путем измерения количества BrdU-позитивных клеток в гиппокампе после субхронического лечения (3,0–4,0 мкг/кг, 4 дня) аналогами спадина. Количество клеток было указано для всего гиппокампа. **p <0,01, ***p <0,001, #p <0,05. (B–D) Синаптогенез оценивали путем измерения увеличения уровня PSD-95 в нейронах коры головного мозга мыши. Нейроны коры головного мозга мышей обрабатывали 0,1 мкм указанного аналога спадина PE 22-28 (B), G/A-PE 22-28 (C) и биотинилированным G/A-PE 22-28 (D). В указанные сроки нейроны гомогенизировали в буфере Laemmli и подвергали вестерн-блоттингу. (E) Иллюстрация гистограммы PSD-95. Для каждого аналога спадина количество PSD-95 через 36 ч было примерно в два раза больше, чем измеренное через 5 ч [2].
Другие периоды неподвижности были нормализованы до 100% значения (рисунок 7B). Расчетные значения времени полувыведения составили 14, 17, 21 и 23 ч для G/A-PE 22-28 (3,2 мкг/кг), биотинилированного G/A-PE 22-28 (4,0 мкг/кг), G/A-PE 22-28 (32 мкг/кг) и биотинилированного G/A-PE 22-28 (40 мкг/кг) соответственно (рисунок 7B). Эти значения были выше, чем ранее полученные со спадином (6 ч) [20].
Рис. 7. Продолжительность действия G/A-PE 22-28 и биотинилированного G/A-PE 22-28 измеряется методом FST. (A) В каждый момент времени 10 наивных мышей тестировали на неподвижность в FST. Мышей, которым вводили физиологический раствор, тестировали только два раза, через 1 и 24 часа. Для каждого аналога спадина на момент времени 1 ч разница между мышами, получавшими физиологический раствор, и мышами, получавшими аналог спадина, считалась равной 100%, время неподвижности на момент времени было нормализовано до этого 100% значения. (B) Эффекты периода полураспада составляли приблизительно 14, 21, 17 и 23 ч для 3,2 мкг/ кг G/A-PE 22-28, 32 мкг/ кг G/A-PE 22-28, 4,0 мкг/ кг биотинилированного G/A-PE 22-28 и 40 мкг / кг биотинилированногоG/A-PE 22-28 соответственно.
Эффективность при когнитивных нарушениях: PE 22-28 может быть полезен в лечении различных когнитивных нарушений, связанных с возрастом или другими факторами, способствуя восстановлению и поддержанию когнитивных функций.
Улучшение когнитивных функций: PE 22-28 также способствует и улучшению памяти у здоровых добровольцев, внимания и способности к обучению, что делает его полезным для людей, стремящихся повысить свои интеллектуальные возможности и работоспособность.
Перспективы в нейропротекции: Исследования показывают, что PE 22-28 обладает нейропротективными свойствами, защищая нервные клетки от повреждений и способствуя их восстановлению, что может быть полезно при лечении нейродегенеративных заболеваний.
Снижение уровня тревожности: Препарат демонстрирует значительное снижение уровня стресса и тревожности, что способствует улучшению общего эмоционального состояния и повышению качества жизни, что может быть полезно для людей, страдающих от различных форм тревожных расстройств, способствуя стабилизации настроения и снижению симптомов депрессии.
Безопасность и минимальные побочные эффекты: PE 22-28 характеризуется высоким профилем безопасности, с редкими и незначительными побочными эффектами, такими как легкие головные боли и усталость, что делает его привлекательным для длительного использования.
Удобство применения: Препарат PE 22-28 может вводиться различными способами, что позволяет адаптировать его применение в зависимости от нужд пациента и обеспечить удобство и эффективность лечения. Наиболее интересным и перспективным на данный момент остаётся интраназальное введение.
Список источников:
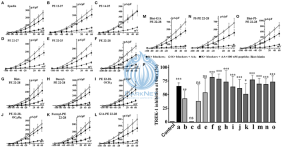
Рис. 2. I = кривые f(V) и % ингибирования TREK-1. (A–F), кривые плотности тока, полученные для спадина и укороченных пептидов, описаны на рисунке 1C. (G–O), кривые плотности тока, полученные для аналогов PE 22-28. (P) Процент ингибирования тока TREK-1, измеренный при 0 мВ для соответствующих пептидов, описанных от “A” до “O”. Контрольное значение было получено с использованием 0,9% раствора NaCl. ns, незначительное. *p < 0,05, **p < 0,01, ***p <0,001 [2].
В дальнейшем были разработаны три других укороченных пептида, PE 22-25, PE 22-27 и PE 22-28 (таблица 1). Ни PE 22-27 (рисунки 2D, P, таблица 1), ни PE 22-25 (рисунки 2E, P, таблица 1) не оказали существенного влияния на ингибирование ITREK-1 (27,5 ±20%, n = 10, p = 0,23) и (36,02 ± 17,5%, n = 14, p = 0,06) соответственно. Только PE 22-28 (рисунки 2F, P, таблица 1) был способен эффективно блокировать активность TREK-1 (55,46 ± 4,6%, n = 13, p < 0,0001).
Депрессия
Депрессия – одно из наиболее распространенных расстройств настроения, которое представляет собой тяжелое экономическое бремя в промышленно развитых странах [2]. Тяжелая депрессия поражает 2-5% граждан России, и до 20% населения страдают легкой депрессией [3]. Депрессия – это сложный синдром с множеством причин, в основном генетических и экологических [3]. Одной из основных гипотез, предложенных для объяснения физиопатологии депрессии, является моноаминовая гипотеза, согласно которой считается, что депрессию вызывает дефицит трех моноаминов – серотонина (5-НТ), норадреналина (NA) или дофамина (DA) [4].Позже было разработано несколько антидепрессантов (AD) с целью восстановления физиологических синаптических уровней трех нейротрансмиттеров [4]. Для лечения депрессии использовались и продолжают использоваться несколько типов препаратов от БА (Болезни Альцгеймера). Первоначально депрессию в основном лечили препаратами семейства трициклических препаратов и в меньшей степени ингибиторами моноаминоксидазы (MAOIs) и ингибиторами обратного захвата серотонина и норэпинефрина (SNRI). Однако эти классы AD проявляют многочисленные и серьезные побочные эффекты.
Чтобы снизить частоту и возникновение этих побочных эффектов, эти препараты были заменены новым поколением ADS, более специфичных и с меньшими побочными эффектами. Сюда входят ингибиторы обратного захвата серотонина (СИОЗС) и ингибиторы обратного захвата норэпинефрина (NSRI), которые широко используются в настоящее время и рекомендуются в качестве лечения депрессии первой линии [2,3]. Считается, что СИОЗС и НПВС повышают синаптическую концентрацию моноаминов за счет ингибирования обратного захвата 5-НТ или NA путем блокирования их специфических переносчиков, SERT и NAT, соответственно [5]. Эти препараты от депрессии лучше переносятся, но их эффективность у пациентов с депрессией на самом деле не улучшилась. С другой стороны, фактические ADS, такие как флуоксетин, эффективны только после 3-4 недель лечения, латентный период, который все еще остается необъяснимым [2,3]. Таким образом, необходимо обнаружить и охарактеризовать новые мишени для новых препаратов от депресии.
Недавно были описаны различные препараты от быстрого развития БА, такие как кетамин, скополамин или GLYX-13 [2,6]. Тем не менее, эти молекулы, особенно кетамин, вызывают ряд побочных эффектов [2]. Мультимодальные препараты, такие как вортиоксетин или вилазодон, представляют собой новый класс ADS, недавно одобренный Управлением по контролю за продуктами питания и лекарствами США для лечения основных депрессивных расстройств [2,7]. Тем не менее, эти препараты не продемонстрировали явного улучшения эффективности антидепрессантов, но вортиоксетин продемонстрировал благоприятное действие при когнитивных нарушениях, связанных с депрессией, тогда как вилазодон, по-видимому, вызывал незначительные сексуальные дисфункции [8].
Несмотря на этот терапевтический арсенал, более 30% пациентов с депрессией никогда не проходят ремиссию даже после нескольких классических методов лечения. Альтернативой медикаментозной терапии у резистентных пациентов является электросудорожная терапия (ЭСТ). ЭСТ эффективна у 50% пациентов, резистентных к фармакотерапии, но ЭСТ также вызывает некоторые побочные эффекты, в основном в когнитивных процессах [2,9]. Таким образом, открытие новых препаратов от депрессии является сложной задачей.
В 2006 году был идентифицирован селективный двухпористый калиевый канал TREK-1 (связанный с TWIK калиевый канал-1) как потенциальная мишень для лечения депрессии [2,10]. Каналы TREK-1 являются повсеместными калиевыми каналами, которые играют ключевую роль в стабилизации мембранного потенциала и, таким образом, предотвращают клеточную возбудимость. Каналы TREK-1 являются очень специфическими K2P каналами, поскольку они вовлечены во многие физиологические и физиопатологические процессы, такие как боль, эпилепсия, инсульт и депрессия [2,10,11]. TREK-1 также стал привлекательной мишенью для исследований сердечно-сосудистой системы, поскольку он играет важную роль в фибрилляции предсердий, легочной артериальной гипертензии и желудочковой аритмии [2].
Что касается депрессии, в статье [10] показано на пяти различных моделях депрессии, что делеция гена kcnk2, который кодирует каналы TREK-1, приводит к устойчивому к депрессии фенотипу, связанному с усиленной серотонинергической нейротрансмиссией и усиленным нейрогенезом в гиппокампе. Эти наблюдения привели ученых к поиску мощных блокаторов TREK-1. Затем они идентифицировали спадин, который происходит из более крупного пептида, называемого пропептидом (PE) [1,2]. PE представляет собой 44 аминокислоты, образующиеся в результате посттрансляционного созревания в аппарате Гольджи сортилина, также известного как рецептор нейротензина-3 [12].
Спадин – это быстродействующий препарат, который не оказывает никаких побочных эффектов на функции, контролируемые каналом TREK-1 [2]. Он способен противодействовать депрессии всего за 4 дня, когда для эффективной классической ADS требуется 3-4 недели [1,2]. Более того, спадин блокирует TREK-1 с более высоким сродством, IC50~ 40-60 нМ по сравнению с IC50~ 6 мкм для наиболее часто используемого флуоксетина СИОЗС [2,13]. Однако у мышей АД-активность спадина, измеряемая методом FST, исчезает через 7 ч после острого внутривенного введения [2]. Чтобы улучшить стабильность спадина in vivo, было решено поискать аналоги или производные спадина. В предыдущих исследованиях были идентифицированы два аналога, аналоги 3 и 8, которые были синтезированы с использованием технологии retro-inverso [2]. Хотя выигрыш в отношении сродства и продолжительности действия составил около 20 единиц, этого недостаточно, чтобы сделать эти аналоги конкурентоспособными в отношении стоимости их синтеза по сравнению со спадином.
Затем было принято решение поискать укороченные аналоги. Сначала ученые изучили, разрушается ли спадин в кровообращении, в свзяи с чем, были идентифицированы два укороченных пептида [2]. Сравнивая их способность ингибировать канал TREK-1, экспрессируемый в клеточной линии hTREK-1 / HEK [13], была идентифицирована самая короткая эффективная последовательность, которая содержала только 7 аминокислот, называемая PE 22-28. Этот пептид использовали в качестве основной последовательности для получения аналогов путем химической модификации его N-или С-концевых окончаний, а также путем замены аминокислот. Как и PE 22-28, некоторые модифицированные пептидные аналоги проявляли лучшую эффективность в блокировании канала TREK-1 и, что более важно, они сохранили свои свойства при лечении депрессии при использовании в момент острой или субхронической формы.
Деградация спадина в сыворотке крови
Из анализа деградации спадина после 30 мин инкубации с сывороткой при 37°C наблюдалось исчезновение почти всего спадина и появление двух других пиков, пика 1 и пика 2 (рисунок 1A). Масс-спектроскопический анализ показал, что пик 1 и пик 2 соответствуют последовательностям PE 14-25 и PE 12-27 соответственно (рисунок 1C). Эти пики появлялись быстро и достигали максимального значения через 15 мин для пика 1 с последующим дальнейшим снижением (рисунок 1B). Напротив, пик 2 достиг своего максимального проявления через 30 мин, который сохранялся до 60 мин (рисунок 1B).Рис. 1. Профили продуктов распада спадина в сыворотке с помощью ВЭЖХ. (А) Типичный профиль ВЭЖХ, полученный после 30-минутной инкубации спадина с мышиной сывороткой при 37°C. Положение пика спадина указано стрелкой. (B) Кинетика появления пиков 1 (PE 14-28) и 2 (PE 12-27). (C) Последовательности укороченных пептидов и их способность ингибировать активность TREK-1 по сравнению с последовательностями PE и спадина (PE 12-28) [2].
Идентификация последовательности PE 22-28 как наиболее эффективного блокатора TREK-1 с более высоким сродством по сравнению со Спадином
Укороченные аналоги спадина подвергали индивидуальному скринингу на клеточной линии hTREK-1/HEK [13] с использованием метода патч-зажима (рисунок 1C). Укороченные пептиды PE показали различия в их способности ингибировать активность TREK-1 по сравнению с последовательностями spadin (PE 12-28) и PE 1-44. Во всех экспериментах (рисунок 2) каналы TREK-1 предварительно активировали 10 мкм АА [14]. Когда была достигнута максимальная амплитуда, была измерена способность каждого пептида при 100 нМ ингибировать активность канала TREK-1, индуцированную AA, и сравнена со спадином (рисунок 2 и таблица 1). Сначала были протестированы два пептида, идентифицированных выше как (PE 14-25 и PE 12-27) (рисунки 2B, C, P). У аналога PE 14-25 не наблюдалось существенного влияния на TREK-1 каналы (рисунки 2C, P). Плотность тока, измеренная при 0 мВ и сравненная с активностью только АА (100%), составила 114,7±10,6% (n = 8, p = 0,09). Интересно, что была обнаружена вохможность PE 12-27 сильно ингибировать активность TREK-1 (28,4 ± 9,9%, n = 22, p = 0,03; Рисунки 2B, P).Таблица 1. Аналоги Спадина и их способность ингибировать активность TREK-1 канала и сокращать время неподвижности при FST [2].
Разработка аналогов спадина
После скрининга этих аналогов на клетках hTREK-1 / HEK PE 22-28 был идентифицирован как наиболее эффективный блокатор TREK-1 и был сохранен для дальнейших исследований [2]. С целью повторного повышения стабильности и эффективности пептида PE 22-28 был использован в качестве основного пептида для разработки нескольких аналогов. Пептиды, которые были способны блокировать активность TREK-1, были описаны на Рисунках 2G–P) и в таблице 1. Они включают биотинилированный PE 22-28, PI-PE 22-28, соответствующий последовательности PE 20-28, биотинилированный-PI-PE 22-28, G/A-PE 22-28, соответствующий последовательности PE 22-28, где глицин в положении 22 заменен остатком аланина, биотинилированный-G /A-PE 22-28, дансил-PE 22-28, где дансильная химическая группа была добавлена в N- конец пептида, О-метил-ПЭ 22-28 и О-этил-ПЭ 22-28, где к С-концу пептидов была добавлена О-метильная или О-этильная химическая группа соответственно.Ученые в работе [2] протестировали и другие аналоги, но они не смогли ингибировать ток TREK-1 (таблица 1). Соответствующие кривые зависимости тока от напряжения показаны на дополнительном рисунке 1.
Все проверенные аналоги, способные ингибировать канал TREK-1, также демонстрировали свойства антидепрессантов, измеренные с помощью теста принудительного плавания (FST) (рисунок 3A, таблица 1).
Рис. 3. Кривые FST и “доза-эффект” текущего ингибирования TREK-1 аналогами спадина. (A) Пептиды, способные ингибировать активность TREK-1 канала, были протестированы в FST. Время неподвижности измеряли через 30 мин после внутривенной инъекции и сравнивали со временем неподвижности, полученным у мышей, которым вводили физиологический раствор. Спадин вводили в дозе 100 мкг / кг, а аналоги спадина вводили в дозе 3,2–4,0 мкг / кг. *p < 0,05, **p < 0,01, ***p <0,001. (B) Кривые зависимости дозы от текущего ингибирования TREK-1 при 0 мВ, полученные с аналогами спадина по сравнению со спадином. IC50 составляли 0,1, 0,12, 1,2 и 40,0 нМ для PE 22-28, G/A-PE 22-28, биотинилированного G/A-PE 22-28 и спадина соответственно [2].
Анализ электрофизиологических и поведенческих данных позволил исследователям сосредоточить дальнейшие исследования на PE 22-28, G / A-PE 22-28 и биотинилированном G / A-PE 22-28. Эти три пептида далее называются аналогами спадина (выделены жирным шрифтом в таблице 1). Они обладали общими свойствами по борьбе с депрессией, высоким процентом текущего ингибирования TREK-1 и имели сродство к TREK-1, которое было значительно увеличено по сравнению со спадином (рисунок 3B). Измеренные значения IC 50 составили 40, 0,12, 0,10 и 1,2 нМ для PE 12-28 (Спадин), PE 22-28, G/A-PE 22-28 и биотинилированного G/A-PE 22-28 соответственно.
PE 22-28 и другие аналоги спадина избирательно блокируют активность канала TREK-1.
PE 22-28 был выбран в качестве репрезентативного пептида среди аналогов спадина и был протестирован на других K2P каналах, таких как hTREK-2, hTRAAK, hTRESK, а также hTASK-1 [15,16]. Нативные клетки HEK трансфицировали плазмидами, кодирующими эти каналы. TREK-2 и TRAAK активировали 10 мкм АА. Затем применяли 100 нМ PE 22-28 в сочетании с AA, когда амплитуда тока достигала максимума. PE 22-28 был неэффективен в обеспечении какого-либо изменения амплитуды тока (рисунки 4A, B). Аналогично, PE 22-28 не смог модифицировать токи, генерируемые hTRESK и hTASK-1, двумя важными K2P каналами в мозге (рисунки 4C, D). Аналоги спадина, представленные PE 22-28, не ингибировали эти K2P каналы, что указывает на то, что они столь же специфичны, как спадин, для блокирования каналов TREK-1.Рис. 4. Специфичность аналогов спадина. (A–D) PE 22-28 использовали в качестве репрезентативного пептида для тестирования специфичности аналогов спадина по сравнению с другими каналами K2P, TREK-2 (A), TRAAK (B), TRESK (C) и TASK-1 (D). (E-G) Аналоги спадина не влияли на активность канала hERG. Плотности тока в конце импульсов (E), плотности тока в хвостовых токах (F) и типичные следы, полученные при +40 мВ с аналогами спадина (G) [2].
Что еще более важно, аналоги спадина, протестированные в более высоких концентрациях (10 мкм), не изменяли ток IKr, генерируемый каналами hERG (рисунки 4E-G). Ток IKr является наиболее важным реполяризующим током в сердце [2,17]. Дисфункция этих каналов может привести к летальному исходу в результате пуантоза, которые являются одним из наиболее важных побочных эффектов, наблюдаемых при применении препаратов от БА [17].
PE 22-28 и другие аналоги спадина проявляют антидепрессивные свойства в тестах на депрессию и на мышиной модели депрессии
После острого внутривенного введения 3,0–4,0 мкг/ кг аналогов спадина время неподвижности мышей значительно сократилось: 91,80 ± 6,1 с (n = 10, p <0,0001), 110,2 ± 6,6 с (n = 10, p <0,0001) и 140,7 ± 7,1 с (n = 10, p = 0,02) для ПЭ 22-28, G/A-PE 22-28 и биотинилированный-G/A-PE 22-28 соответственно, значения, которые необходимо сравнить с таковыми для солевого раствора (161,7 ± 6,49 с) (рисунок 3А).Как и спадин, аналоги спадина были эффективны после субхронического лечения. Независимо от того, вводились ли они внутривенно (3,0 мкг / кг) или через зонд (1 мг / кг) (рисунок 5A), они оставались активными в течение длительного времени. Затем ученые подвергли мышей тесту на выученную беспомощность, валидированному и эффективному тесту для идентификации молекул депрессии. 4-дневное субхроническое лечение аналогами спадина (3,0 мкг / кг, ip) значительно уменьшило латентность выхода (рисунок 5B).
В химически индуцированной модели депрессии с использованием длительного (7 недель) лечения кортикостероном [18] PE 22-28 проявлял те же свойства АД, что и спадин, после острого или субхронического лечения (3,0 мкг/кг) (Рисунки 5C-E). В ФСТ, ЧП 22-28 (3.0 мкг/кг, ИП) был немного более эффективным в уменьшении неподвижности времени (98.1 ± 8.78 ы, н = 10, П < 0.0001), чем спадин (100 мкг/кг; 117.4 ± 6.85 ы, н = 10, П < 0.0001) в этой модели депрессии по сравнению с контролем (164.9 ± 6.03 ы) (рис. 5С). Более того, 4-дневные субхронические введения аналогов спадина были значительно эффективнее в сокращении времени неподвижности (89,60 ± 7,7 с, n = 10, p <0,0001) по сравнению со спадином (107,5 ± 6,5 с, n = 10, p <0,0001) или физиологическим раствором (158,3 ±7,15 с, n = 10; Рисунок 5D). Эти данные подтвердили адгезивное действие аналогов спадина на контрольных мышей с депрессией, индуцированной кортикостероном.
Рис. 5. Поведение аналогов спадина на мышиной модели депрессии. (A) FST, выполненную после субхронического (4 дня) лечения (3,0–4,0 мкг / кг) каждым аналогом спадина или 0,9% физиологическим раствором NaCl. Лечение проводилось либо внутривенной инъекцией (100 мкг / кг), либо через зонд (1,0 мг / кг). (B) Тест на выученную беспомощность проводили с каждым аналогом спадина (3,0–4,0 мкг / кг). 30 исследований были разделены на 6 пулов по пять испытаний. *p < 0,05. (C, D) Модель депрессии, индуцированная кортикостероном. PE 22-28 использовали в качестве репрезентативного пептида для аналогов спадина для сравнения эффектов аналогов спадина с эффектами спадина в этой химически индуцированной модели мыши. FST проводится после острой (через 30 мин после инъекции, (C) или субхронической (4 дня лечения, D) внутривенной инъекции спадина (100 мкг / кг) или PE 22-28 (3,0 мкг / кг). До NSF также применялись субхронические методы лечения, назначаемые в тех же дозах (E). *p < 0,05, **p < 0,01, ***p <0,001 [2].
При NSF 4-дневное субхроническое лечение PE 22-28 (3 мкг/кг) или спадином (100 мкг/кг) значительно уменьшало задержку перед употреблением пищевой таблетки (129,2 ± 15,28 с, n = 10, p < 0,05) и (153,2 ± 5,41 с, n = 10, p < 0,05) в группах спадина и PE 22-28, соответственно по сравнению с контролем (226,1±34,97 с, n = 10) в модели депрессии, индуцированной кортикостероном (рисунок 5E). Тест NSF предсказывает не только депрессию, но и нейрогенез [2,19]. Начуное сообщество предпологает, что аналоги спадина могут усиливать нейрогенез в коре головного мозга и гиппокампе.
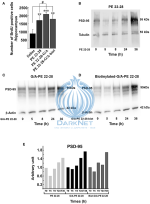
PE 22-28 и другие аналоги спадина усиливаеют нейрогенез in Vivo в гиппокампе после 4-дневного лечения
Несколько исследований продемонстрировали, что хроническое лечение БА усиливает нейрогенез в гиппокампе [2,19]. В работе [1] показано, что спадин усиливал нейрогенез и активацию CREB в гиппокампе только после 4-дневного лечения. Научное сообщество задалось вопросом – вызывают ли аналоги спадина такие же эффекты. Мышей лечили внутривенно (3,0–4,0 мкг/кг / сут) аналогами спадина в течение 4 дней и на 5-й день умерщвляли. 4-дневное лечение аналогами спадина значительно увеличило количество BrdU-позитивных клеток (1736 ± 126 (n = 5, p < 0.0001), 2110 ± 132, (n = 5, p <0,0001), 1809 ± 267 (n = 5, p <0,0001) для PE 22-28, G/A-PE 22-28 и биотинилированного G/A-PE 22-28 соответственно) по сравнению с мышами, которым вводили физиологический раствор (899±109, n = 5) (рисунок 6A). Эти данные подтвердили, что, подобно спадину, аналоги спадина сохранили свою способность индуцировать in vivo нейрогенез гиппокампа.Рис. 6. Рисунок 6. Нейрогенез и синаптогенез. (A) Нейрогенез оценивали путем измерения количества BrdU-позитивных клеток в гиппокампе после субхронического лечения (3,0–4,0 мкг/кг, 4 дня) аналогами спадина. Количество клеток было указано для всего гиппокампа. **p <0,01, ***p <0,001, #p <0,05. (B–D) Синаптогенез оценивали путем измерения увеличения уровня PSD-95 в нейронах коры головного мозга мыши. Нейроны коры головного мозга мышей обрабатывали 0,1 мкм указанного аналога спадина PE 22-28 (B), G/A-PE 22-28 (C) и биотинилированным G/A-PE 22-28 (D). В указанные сроки нейроны гомогенизировали в буфере Laemmli и подвергали вестерн-блоттингу. (E) Иллюстрация гистограммы PSD-95. Для каждого аналога спадина количество PSD-95 через 36 ч было примерно в два раза больше, чем измеренное через 5 ч [2].
PE 22-28 и другие аналоги спадина усиливают синаптогенез in Vitro в нейронах коры головного мозга
Инкубация кортикальных нейронов с 0,1 мкм аналогов спадина усиливала синаптогенез, что иллюстрируется увеличением экспрессии PSD-95 через 36 ч после инкубации (рисунки 6B-D). За исключением небольшого снижения в течение первых 5 ч, лечение аналогом спадина непрерывно увеличивало экспрессию PSD-95 до 36 ч (рисунок 6E). Эти данные показали, что аналоги спадина не только усиливают нейрогенез, но и синаптогенез, указывая на то, что судьба большинства новорожденных клеток – генерировать зрелые нейроны [2].Продолжительность действия PE 22-28
Необученным мышам (по 10 в каждой временной группе) вводили однократно для получения дозы 3,2 мкг/кг или 32 мкг /кг G/A-PE 22-28 или дозы 4,0 мкг/кг или 40 мкг / кг биотинилированного G/A-PE 22-28. Эти дозы вводили болюсно по 100 мкл 0,9% NaCl. Время от времени 1, 3, 5, 7, 12, 16, 20, и через 24 ч после инъекции мышей подвергали FST (рисунок 7A). Время неподвижности сравнивали с таковым, полученным у мышей, которым вводили физиологический раствор (0,9% NaCl). FST мышам, которым вводили физиологический раствор, проводили только с интервалами 1 и 24 ч, время неподвижности было очень схожим, 171,2±8,2 с и 175,5±6,8 с соответственно (рисунок 7A). Для расчета времени полувыведения время неподвижности, измеренное через 1 час мышам, которым вводили физиологический раствор, вычитали из времени неподвижности, измеренного через 1 час для аналогов спадина, значение разницы считали равным 100% [2].Другие периоды неподвижности были нормализованы до 100% значения (рисунок 7B). Расчетные значения времени полувыведения составили 14, 17, 21 и 23 ч для G/A-PE 22-28 (3,2 мкг/кг), биотинилированного G/A-PE 22-28 (4,0 мкг/кг), G/A-PE 22-28 (32 мкг/кг) и биотинилированного G/A-PE 22-28 (40 мкг/кг) соответственно (рисунок 7B). Эти значения были выше, чем ранее полученные со спадином (6 ч) [20].
Рис. 7. Продолжительность действия G/A-PE 22-28 и биотинилированного G/A-PE 22-28 измеряется методом FST. (A) В каждый момент времени 10 наивных мышей тестировали на неподвижность в FST. Мышей, которым вводили физиологический раствор, тестировали только два раза, через 1 и 24 часа. Для каждого аналога спадина на момент времени 1 ч разница между мышами, получавшими физиологический раствор, и мышами, получавшими аналог спадина, считалась равной 100%, время неподвижности на момент времени было нормализовано до этого 100% значения. (B) Эффекты периода полураспада составляли приблизительно 14, 21, 17 и 23 ч для 3,2 мкг/ кг G/A-PE 22-28, 32 мкг/ кг G/A-PE 22-28, 4,0 мкг/ кг биотинилированного G/A-PE 22-28 и 40 мкг / кг биотинилированногоG/A-PE 22-28 соответственно.
Отзывы пользователей:
Пользователи препарата PE 22-28 отмечают значительное улучшение когнитивных функций и снижение уровня тревожности. Многие пациенты сообщают об улучшении памяти, внимания и способности к обучению после курса лечения. Некоторые также отмечают снижение уровня стресса и улучшение настроения. В редких случаях упоминаются незначительные побочные эффекты, такие как легкие головные боли и усталость. В основной массе, большинство отзывов позитивные, и пользователи довольны результатами терапии.Выводы:
Итак, в заключение, сформируем главные выводы о препарате PE 22-28:Эффективность при когнитивных нарушениях: PE 22-28 может быть полезен в лечении различных когнитивных нарушений, связанных с возрастом или другими факторами, способствуя восстановлению и поддержанию когнитивных функций.
Улучшение когнитивных функций: PE 22-28 также способствует и улучшению памяти у здоровых добровольцев, внимания и способности к обучению, что делает его полезным для людей, стремящихся повысить свои интеллектуальные возможности и работоспособность.
Перспективы в нейропротекции: Исследования показывают, что PE 22-28 обладает нейропротективными свойствами, защищая нервные клетки от повреждений и способствуя их восстановлению, что может быть полезно при лечении нейродегенеративных заболеваний.
Снижение уровня тревожности: Препарат демонстрирует значительное снижение уровня стресса и тревожности, что способствует улучшению общего эмоционального состояния и повышению качества жизни, что может быть полезно для людей, страдающих от различных форм тревожных расстройств, способствуя стабилизации настроения и снижению симптомов депрессии.
Безопасность и минимальные побочные эффекты: PE 22-28 характеризуется высоким профилем безопасности, с редкими и незначительными побочными эффектами, такими как легкие головные боли и усталость, что делает его привлекательным для длительного использования.
Удобство применения: Препарат PE 22-28 может вводиться различными способами, что позволяет адаптировать его применение в зависимости от нужд пациента и обеспечить удобство и эффективность лечения. Наиболее интересным и перспективным на данный момент остаётся интраназальное введение.
Список источников:
- Mazella, Jean, et al. “Spadin, a sortilin-derived peptide, targeting rodent TREK-1 channels: a new concept in the antidepressant drug design.” PLoS biology4 (2010): e1000355.
- Djillani A, Pietri M, Moreno S, Heurteaux C, Mazella J, Borsotto M. Shortened Spadin Analogs Display Better TREK-1 Inhibition, In Vivo Stability and Antidepressant Activity. Front Pharmacol. 2017 Sep 12;8:643. doi: 10.3389/fphar.2017.00643. PMID: 28955242; PMCID: PMC5601071.
- Nestler, Eric J., et al. “Neurobiology of depression.” Neuron 34.1 (2002): 13-25.
- Hillhouse, Todd M., and Joseph H. Porter. “A brief history of the development of antidepressant drugs: from monoamines to glutamate.” Experimental and clinical psychopharmacology 23.1 (2015): 1.
- Köhler, Stephan, et al. “The serotonergic system in the neurobiology of depression: Relevance for novel antidepressants.” Journal of Psychopharmacology 30.1 (2016): 13-22.
- Ramaker, M. J., and S. C. Dulawa. “Identifying fast-onset antidepressants using rodent models.” Molecular psychiatry 22.5 (2017): 656-665.
- Wang, Sheng-Min, et al. “Vilazodone for the treatment of major depressive disorder: focusing on its clinical studies and mechanism of action.” Psychiatry investigation 12.2 (2015): 155.
- Deardorff, William James, and George T. Grossberg. “A review of the clinical efficacy, safety and tolerability of the antidepressants vilazodone, levomilnacipran and vortioxetine.” Expert opinion on pharmacotherapy 15.17 (2014): 2525-2542.
- Semkovska, Maria, and Declan M. McLoughlin. “Objective cognitive performance associated with electroconvulsive therapy for depression: a systematic review and meta-analysis.” Biological psychiatry 68.6 (2010): 568-577.
- Heurteaux, Catherine, et al. “Deletion of the background potassium channel TREK-1 results in a depression-resistant phenotype.” Nature neuroscience 9.9 (2006): 1134-1141.
- Lauritzen, Inger, et al. “Polyunsaturated fatty acids are potent neuroprotectors.” The EMBO journal (2000).
- Mazella, Jean. “Sortilin/neurotensin receptor-3: a new tool to investigate neurotensin signaling and cellular trafficking?.” Cellular signalling 13.1 (2001): 1-6.
- Moha ou Maati, Hamid, et al. “A human TREK-1/HEK cell line: a highly efficient screening tool for drug development in neurological diseases.” PloS one 6.10 (2011): e25602.
- Patel, Amanda J., et al. “A mammalian two pore domain mechano‐gated S‐like K+ channel.” The EMBO journal (1998).
- Lesage, Florian, and Michel Lazdunski. “Molecular and functional properties of two-pore-domain potassium channels.” American Journal of Physiology-Renal Physiology 279.5 (2000): F793-F801.
- Lauritzen, Inger, et al. “K+-dependent cerebellar granule neuron apoptosis: role of TASK leak K+ channels.” Journal of Biological Chemistry 278.34 (2003): 32068-32076.
- Cheng, Jian-Hua, and Itsuo Kodama. “Two components of delayed rectifier K^+ current in heart: molecular basis, functional diversity, and contribution to repolarization.” Acta Pharmacologica Sinica 25.2 (2004): 137-145.
- Zhao, Yunan, et al. “A mouse model of depression induced by repeated corticosterone injections.” European journal of pharmacology 581.1-2 (2008): 113-120.
- Duman R. S., Nakagawa S., Malberg J. Regulation of adult neurogenesis by antidepressant treatment //Neuropsychopharmacology. – 2001. – Т. 25. – №. 6. – С. 836-844.
- Veyssiere J. et al. Retroinverso analogs of spadin display increased antidepressant effects //Psychopharmacology. – 2015. – Т. 232. – С. 561-574.
Рис. 2. I = кривые f(V) и % ингибирования TREK-1. (A–F), кривые плотности тока, полученные для спадина и укороченных пептидов, описаны на рисунке 1C. (G–O), кривые плотности тока, полученные для аналогов PE 22-28. (P) Процент ингибирования тока TREK-1, измеренный при 0 мВ для соответствующих пептидов, описанных от “A” до “O”. Контрольное значение было получено с использованием 0,9% раствора NaCl. ns, незначительное. *p < 0,05, **p < 0,01, ***p <0,001 [2].
В дальнейшем были разработаны три других укороченных пептида, PE 22-25, PE 22-27 и PE 22-28 (таблица 1). Ни PE 22-27 (рисунки 2D, P, таблица 1), ни PE 22-25 (рисунки 2E, P, таблица 1) не оказали существенного влияния на ингибирование ITREK-1 (27,5 ±20%, n = 10, p = 0,23) и (36,02 ± 17,5%, n = 14, p = 0,06) соответственно. Только PE 22-28 (рисунки 2F, P, таблица 1) был способен эффективно блокировать активность TREK-1 (55,46 ± 4,6%, n = 13, p < 0,0001).